转自:药明康德
Warburg效应,即在氧气充足的条件下,糖酵解通路异常激活是胶质母细胞瘤的重要代谢特征,然而该效应如何影响胶质母细胞瘤的临床治疗以及该过程的分子调控机制尚不明确。
近日,首都医科大学附属北京天坛医院神经外科学中心江涛院士、张伟教授团队在《细胞-代谢》在线发表研究论文。
研究首次阐明了胶质瘤干细胞生物标志物ALDH1A3,通过别构激活糖酵解通路关键酶PKM2,介导胶质母细胞瘤葡萄糖代谢重编程并导致乳酸堆积的分子机制;
研究证实细胞内堆积的乳酸可促使DNA损伤修复相关蛋白XRCC1发生乳酰化修饰和核转运增加,最终介导胶质母细胞瘤的放化疗抵抗;
该研究还基于高通量小分子药物筛选平台鉴定出靶向PKM2别构激活位点的小分子抑制剂——D34-919,并通过体内外模型证实D34-919药物可以阻断ALDH1A3与PKM2互作,逆转ALDH1A3介导的糖酵解异常激活,抑制肿瘤细胞DNA损伤修复,从而增强胶质母细胞瘤对放化疗的敏感性。

张伟教授团队证实,胶质瘤干细胞重要标志物ALDH1A3表达阳性的胶质母细胞瘤对常规放化疗均不敏感,并通过胶质瘤干细胞数据库及代谢组学分析,首次证实ALDH1A3通过与糖酵解限速酶PKM2互作,激活糖酵解通路并介导肿瘤细胞内乳酸堆积。该发现阐明了胶质母细胞瘤Warburg效应的调控机制,并且证实ALDH1A3通过异常激活糖酵解通路介导胶质母细胞瘤的放化疗抵抗。
该团队进一步研究发现,ALDH1A3介导的肿瘤细胞内乳酸堆积,主要通过DNA损伤修复相关蛋白XRCC1K247位点的乳酰化修饰,促进胶质母细胞瘤的DNA损伤修复功能,最终导致胶质母细胞瘤对放化疗的抵抗。该研究研发了XRCC1K247位点乳酰化修饰的兔源特异性抗体,可以作为临床检测工具,用于检测临床样本中XRCC1的乳酰化修饰水平。
基于上述机制研究,该团队通过小分子化合物高通量筛选平台,成功筛选出靶向PKM2激活位点的小分子抑制剂——D34-919,并利用胶质瘤干细胞系、小鼠原位成瘤模型以及胶质瘤类器官模型证实D34-919小分子药物可以有效阻断ALDH1A3与PKM2互作,降低肿瘤细胞内乳酸浓度及XRCC1乳酰化修饰水平,从而抑制DNA修复功能,提高胶质母细胞瘤对放化疗的敏感性。在动物模型中,该药物还表现出较高的血脑屏障通过率及良好的安全性,已申报国家发明专利,有望成为胶质母细胞瘤患者全新的靶向药物。
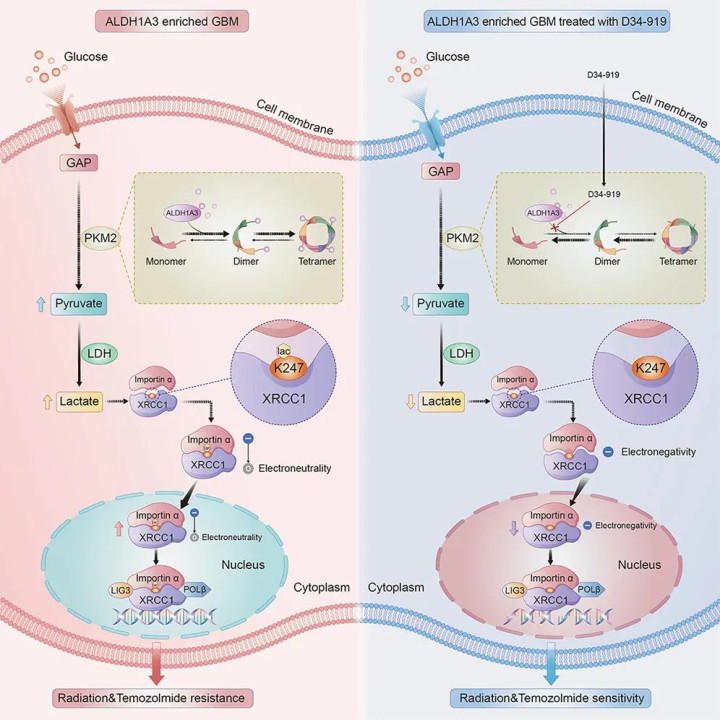
▲研究示意图(图片来源:原始论文[1])
综上,该研究揭示了非糖酵解酶ALDH1A3与PKM2的相互作用增强糖酵解和乳酸生成的机制,并展示了Warburg效应通过乳酸介导的蛋白乳酰化调控DNA损伤修复的全新发现,干预这一过程在提高胶质母细胞瘤对DNA损伤诱导疗法的敏感性方面具有令人期待的潜力。
首都医科大学附属北京天坛医院主治医师李冠璋与博士研究生王地为共同第一作者,首都医科大学附属北京天坛医院神经外科学中心江涛院士与张伟教授(末位通讯)为共同通讯作者。
原始论文:
[1]Lietal.Glycometabolicreprogramming-inducedXRCC1lactylationconferstherapeuticresistanceinALDH1A3-overexpressingglioblastoma.CellMetabolism(2024).https://doi.org/10.1016/j.cmet.2024.07.011
